Johann Kern, jo_kgmx.net
Монография [1] опубликована как бумажная книга на русском языке в 2010 г., и, кроме того, опубликована в интернете. В части 3 «Спектр излучения газов (Устройство атома)» было показано, какие минимальные требования надо предъявить к модели атома, чтобы она возможно более соответствовала реальности, и, кроме того, могла объяснить спектр излучения газов без необходимости применения тех мистических предположений, которые были сделаны в «квантовой физике». Предположения Бора и других публикуемых в официальных изданиях «физиков» начала 20-го века, как известно, привели к «физике», в которой не делаются попытки объяснить причину (теоретических) событий, и теория атома рассматривает чисто математические модели, которые очень далеки от реальности.
В части 4 «Наглядное моделирование химических свойств атомов и молекул (Устройство атома)» были найдены требования, которые надо предъявить к конструкции отдельных атомов и молекул, чтобы на их основе можно было объяснить наблюдаемые химические свойства атомов и молекул. Эти предположения оказались настолько успешными, что на их основе даже удалось объяснить некоторые факты, которые раньше химикам объяснить не удавалось. Последнее позволяет надеяться, что этим найден новый неформальный путь в физической химии, который позволит приблизиться к лучшему пониманию сущности химических реакций.
Но так как это была первая работа в этом направлении, то автор ограничился очень небольшим набором молекул, возможную конструкцию которых он попытался представить.
Несколько дней тому назад (январь 2021) автор получил письмо от одного из своих читателей, в которой тот приводит следующую цитату:
«В молекуле воды угол между связями О—Н равен не 90°, как можно было ожидать., исходя из угла между осями двух р-орбиталей атома кислорода, а приближается к тетраэдрическому (109,5 ) и составляет 104,5°. Вероятно, это можно объяснить sp-гибридизацией (см. гл. Ill, 4) четырех атомных орбиталей кислорода. [c.90]» [2].
Мой читатель спрашивает: «Не могли бы Вы показать, как на Ваш взгляд выглядит молекула воды, и есть ли у Вас та же трудность с углом между ядрами водорода?»
Со дня публикации немецкого варианта книги прошло уже более 12 лет, и я в своих мыслях неоднократно возвращался к идее наглядного моделирования химических свойств атомов и молекул, и понял, что возможны различные варианты расположения кольцеобразных электронов относительно ядра, но конкретного существенного улучшения идеи я не нашёл. У меня уже давно возникло желание переиздания книги со значительным её дополнением, но дополнение в основном касалось оптики и лучшего представления ядерных сил.
Получив письмо от читателя, я стал мысленно представлять конструкцию молекулы воды. Она ни в коем случае не является более сложной, чем уже представленные в книге [1]. Но она явно допускает несколько различных вариантов её представления, что в какой-то мере отражает наблюдающееся многообразие свойств молекул воды. Поэтому я подумал, что мой ответ должен быть адресован не единственному читателю, и должен быть опубликован в виде статьи.
К сожалению, я не знаю, каким способом измеряется указанный угол. В имеющейся у меня литературе я по этому поводу ничего не нашёл. Безуспешными оказались и мои поиски в интернете. Меня интересовал вопрос, может ли данный угол измеряться на отдельной молекуле воды, что мне кажется весьма маловероятным. В этом случае у меня не меньшая проблема, чем у «квантовой» физики. Если же он измеряется по отношению к большому числу молекул, то я на основе принятых предположений легко могу объяснить, почему измеренный угол более 90°, но указать его точную величину я ни в коем случае не могу. Но к таким тонкостям я никогда и не стремился, считая, что задача физика чисто качественная, но ни в коем случае не ловля блох.
Чтобы понять, как выглядит молекула воды, можно было бы для начала посмотреть, как выглядит молекула кислорода и две молекулы водорода. После этого было бы хорошо показать их относительное положения, исходя из которого можно легко собрать из них две молекулы воды. К сожалению, этот путь невозможен. Стехиометрическая смесь водорода и кислорода может неопределённо долго находиться в некотором сосуде без того, чтобы между ними происходила химическая реакция. Совершенно ясно, что при этом постоянно возникают самые различные относительные положения молекул водорода и кислорода, в том числе и «самые выгодные». Но при этом ничего не происходит, химическая реакция не идёт. Но стоит произвести в любом месте этого сосуда небольшой искровой разряд, и сразу же происходит взрыв. Реакция происходит мгновенно и если наш сосуд выдержал взрыв, в нём появится горячий водяной пар.
Это заставляет предположить, что перед реакцией (под действием искры) происходит разборка молекул водорода и кислорода на составляющие, по крайней мере, на атомы. А атомы уже легко вступают в реакцию. Конечный результат этого уже можно довольно легко представить.
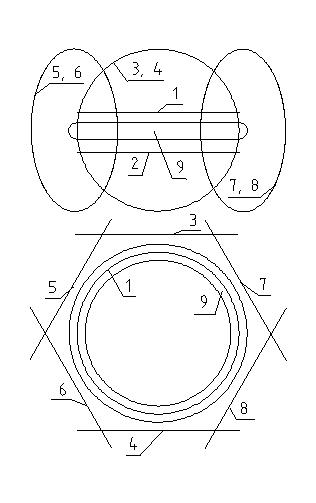
На рис. 1 в виде двух проекций показано, как может выглядеть атом кислорода. Цифрами 1-8 показаны электроны, имеющие форму кольца. Но так как электрон очень лёгкий, то он показан просто в форме окружности. Ядро кислорода 9 также имеет форму кольца (тора), но та
к как оно по крайней мере на 4 порядка тяжелее электрона, то оно показано имеющим некоторый объём. Ядро кислорода имеет положительный заряд, а электроны —

Рис. 1. Атом кислорода.
отрицательный. Поэтому они стремятся расположиться поближе к ядру. В соответствии со сделанными предположениями в непосредственной близости друг от друга все элементарные частички отталкиваются. Поэтому электроны нигде не соприкасаются с ядром.
Внутренняя электронная оболочка состоит из двух электронов 1 и 2, образуя с ядром кислорода подобие конфигурации гелия. Электроны 3 — 8 образуют вторую электронную оболочку. До конфигурации химически нейтрального неона в этой оболочке не хватает двух электронов. Поэтому электроны 3-8 расположены не слишком тесно вокруг ядра кислорода. Между ними могут втиснуться ещё два электрона. Поэтому атомарный кислород химически весьма активен.
Предполагаемую конструкцию атома и молекулы водорода читатель может посмотреть в [1].
Получив в результате реакции с водородом от двух атомов водорода два дополнительных электрона (рис. 2), новая электронная оболочка приближается к конфигурации электронной оболочки неона. Поэтому молекула воды гораздо менее активна, чем атомарный кислород.
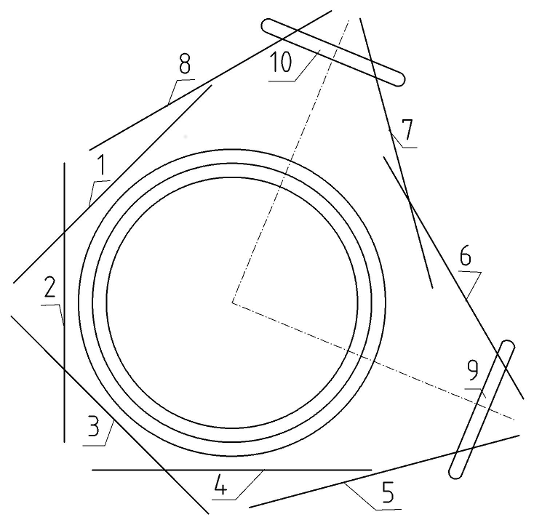
Рис. 2
Молекула воды представлена на рис. 2 только одной проекцией. Тот, кто хорошо разобрался с рис. 1, может всё понять и на основе единственной проекции. Электроны 1- 4 на рис. 2 относятся ко второй электронной оболочке атома кислорода и только немного сдвинуты относительно друг друга по сравнению с проекцией на рис. 1, чтобы дать место двум электронам, присоединившимся к атому кислорода вместе с двумя протонами (ядрами водорода) 9 и 10. Четыре электрона 5-9 одной стороной кольца притянуты к ядру атома кислорода, а другим - к одному из ядер водорода. Ядра водорода отталкиваются от ядра кислорода, но каждое из них удерживается с двух сторон двумя электронами. Ядро водорода также имеет форму кольца, но оно намного легче и имеет радиус примерно в два раза менее ядра кислорода. Кольцо ядра кислорода показано сверху, а кольца ядра водорода — сбоку. Угол между двумя осями симметрии ядер водорода (показаны штрих-пунктирными линиями) 9 и 10, исходящими из центра ядра кислорода, показан равным 90°. При этом не учтено возможное смещение электронов, которое может возникнуть из-за того, что ядра водорода, имея одинаковый заряд, отталкиваются друг от друга.
На данном этапе разработки моделей атома невозможно указать точное относительное расстояние электронов от ядра кислорода, а также их действительное угловое положение на рисунке. Конструкции молекул следует рассматривать как схематические. Поэтому на рис. 3 ещё раз показан возможный вид молекулы воды, на котором электроны второй оболочки расположены несколько далее от центра ядра атома кислорода 1. Они также показаны с несколько иным угловым положением друг относительно друга. При этом учтено, это электроны не могут соприкасаться друг с другом. Цифрами 2 и 3 показаны ядра атомов водорода.
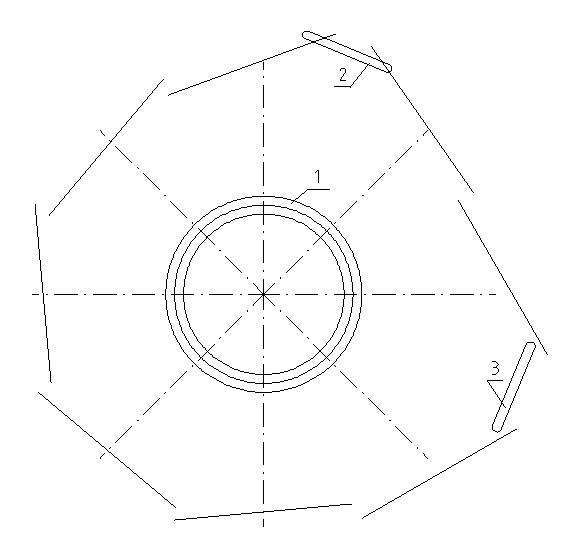
Рис. 3
На рис. 2 и 3 ядра атомов водорода показаны по отношению к центру ядра атома кислорода под углом 90°. Так как ядра атомов водорода оба положительно заряжены, то они отталкиваются друг от друга. Вследствие этого все угловые положения элементов, показанных на рис. 2 и 3, относительно центра ядра кислорода, должны несколько измениться и угол между ядрами водорода окажется несколько больше 90°. Но насколько? Это сказать трудно. Сказать, что он будет равен именно 104,5°, было бы слишком необоснованным.
Внимательный читатель повидимому уже заметил, что на рис. 2 и 3 показана явно не единственная возможность того, как может выглядеть молекула воды. Совершенно равноправен вариант, показанный на рис. 4. (Обозначения на нём тре же, что и на рис. 3). Здесь угол между ядрами атомов водорода (без учёта возможного сдвига из-за отталкивания двух ядер водорода друг от друга) равен 135°, а вследствие сил отталкивания между ними он
будет даже несколько больше. Кроме того ясно, что возможен и третий вариант, где угол между ядрами атомов водорода будет равен 180° (на рис. не показан).
Какой же из этих трёх углов соответсвует действительности?
Возможно, все три. Но вероятность этих положений по каким-то причинам различна, а усреднённое положение как раз и может соответствовать углу 104,5°, который находят путём измерений.
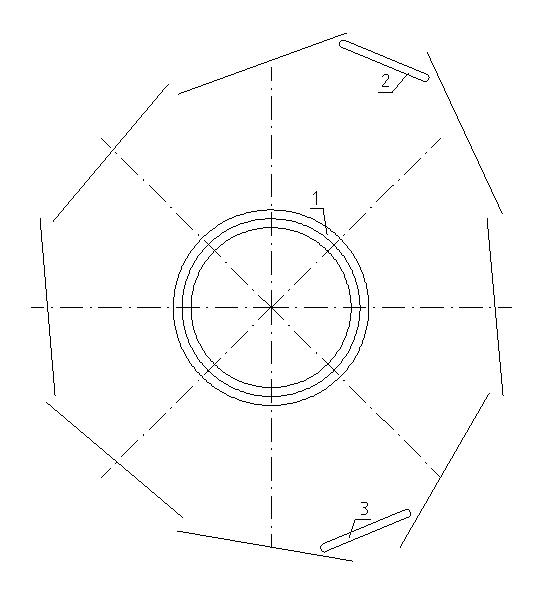
Рис. 4
Ответить на этот вопрос пока невозможно. Но можно предположить, что преимущественное положение этих углов может зависеть от агрегатного состояния воды — жидкость, пар, лёд. Насколько возможно такое предположение, зависит от метода измерения полученного угла 104,5°.
Моя искренняя благодарность тому из читателей, кто пришлёт мне информацию об этом методе измерения.