В статье показано, что водные растворы не разлагаются на ионы. Этот вывод имеет большое значение для теории как в биологии, так и во многих других отраслях науки, имеющих дело с водными растворами. Кроме того, приведённое доказательство позволяет дать ещё одно объяснение магнитных аномалий, что может представлять интерес для разведки руд.
Я много раз менял название этой статьи, пока не остановился на последнем. Конечно, с одной стороны – важно выделить физическую сущность, вопрос о разложении на ионы. Но, с другой стороны – без наличия новой теории я бы никогда не обратил внимание на существующие в принятой всеми старой теории противоречиях, о которых здесь пойдёт речь. Поэтому я прежде всего хотел бы обратить внимание читателя на существование новой теории, которая позволяет многое видеть совсем иначе. Воспользуется читатель этим намёком или нет, - это будет уже его личным решением.
Всё началось со чтения очень живо написанного американского учебника по молекулярной биологии клеток. Но книга написана не только очень живо. В ней невероятное количество мест, которым не хочется верить. Чувствуется, что авторы объясняют то, чего сами не понимают. То, что я в этом своём мнении, по-видимому, не одинок, я понял из случайно прочитанной фразы одной докторши-химички: «Биология — это ещё не наука». Но я не хотел бы быть столь резким в своём мнении. Но меня постоянно раздражало то, что биологи очень много „оперируют“ с ионами. Откуда в живой клетке могут быть ионы? Ну ладно, где-то затесался ион. Может случиться. Но нет, чуть ли не вся биология якобы построена на «ионах» и «ионных насосах». Для меня ион – это наличие напряжения порядка 10 вольт, а то и больше. Как в живой клетке может быть такое напряжение или разность потенциалов?
В 2007 году я опубликовал небольшую книжку, части 3 и 4 которой посвящены новой гипотезе построения атома (В 2010 году вышло расширенное русское издание [1]). Написал я её по той причине, что никак не мог примириться с многочисленными противоречиями общепринятой теории атома (Нильс Бор и Со.) Эта гипотеза позволила мне объяснить без прибегания к колдовским или „магическим“ методам безупречных физиков 20-го века, не подлежащих критике, не только некоторые физические факты, представленные в принятой теории весьма неправдоподобно, но и существование или отсутствие некоторых химических соединений, служивших предметом спора химиков в течение нескольких сотен лет. Новая гипотеза позволяет мне совсем по другому смотреть на наш мир. Но я далёк от мнения безупречных физиков 20-го века, считавших свою модель не подлежащей критике. Поэтому с тех пор я постоянно нахожусь в поиске фактов, могущих дополнительно подтвердить или опровергнуть мою гипотезу. Как раз такие факты мне подкинула молекулярная биология клеток.
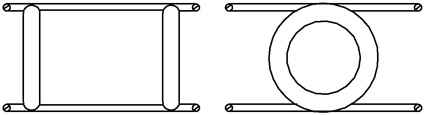
По моей гипотезе атомы в молекулах не дарят друг другу свои электроны, а постоянно держатся за них, или, если хотите, всегда находятся при них. Связь атомов в молекуле по моей гипотезе — это нечто вроде дружеского объятия двух человек. Атомы в ней равноправны. В молекулах нет атомов берущих или отдающих электроны. Разумеется, только что сказанное выше не является идеей моей гипотезы и, тем более, не её объяснением. Тем, кто ею заинтересуется и захочет её понять, надо будет прочитать значительно более 2-х строк. Чтобы дать намёк на то, как выглядят модели моих атомов, я для примера привожу модель молекулы водорода (Рис. 1), состоящую из двух протонов (толстые кольца) и двух электронов (тонкие кольца). Электроны и протоны притягивают друг друга, вблизи же начинают отталкиваться. Поэтому модели атомов являются статичными. Модель атома допускает относительное движение своих элементов, но в обычной ситуации они перемещаются на расстояние не более одного радиуса электрона, т. е. радиуса тонкого кольца, показанного на рис. 1.

Как видно из рисунка, модель имеет двойную зеркальную симметрию. Конечно, молекулы, состоящие из различных атомов, не столь симметричны, но о них никогда нельзя сказать, что один из атомов захватил электроны другого.
Поэтому я не могу представить себе химическую реакцию, в которой дело могло бы дойти до ионизации. Насколько мне известно, ионизация в массовом количестве может иметь место только при повышенных температурах, настолько высоких, что химия ими пока ещё не пользуется. Это область не объединения атомов в молекулы, а область распадения молекул. Энергия связи атомов в молекулах, как правило, значительно ниже энергии ионизации. Поэтому уж где-где, а в биологических системах земного типа, никакие ионы, конечно, находиться не могут. Но... современная биология считает иначе.
Я стал искать возможность убедить «даже биологов» в том, что такого быть не может. И тут столкнулся с фактом, что похоже, вся современная наука... согласна в этом отношении с биологами. Странно. А я то думал, что их неграмотные физики консультировали. Тут надо быть осторожным.
Так начались мои поиски веского доказательства, которому будут вынуждены поверить не только биологи, но и химики и физики. Вам, читающим эти строки, судить о том, сумел ли я такие доказательства найти.
Если описывать мои блуждания в потёмках, мог бы получиться целый роман. Поэтому буду краток. Моя собственная попытка объяснить электролиз, исходя из отсутствия диссоциации электролита на ионы, завела меня в тупик. Я пришёл к выводу, что электролизёр не должен бы потреблять ток. Этот результат меня, естественно, смутил. Явный изъян моей гипотезы? Но потом оказалось, что причиной смущения является непонимание мной одного явления, которое, похоже, не понимают и другие.
Мне посчастливилось найти эксперимент, который кто-то сделал как бы специально для меня [2]. Это исследование электролиза или электролизёра при параметрах до начала электролиза. Обдумывание результатов этого эксперимента позволило мне многое понять, но, на мой взгляд, только по той причине, что я имею возможность иначе смотреть на мир (см. выше), а потому несколько иначе оценивать явления.
Итак, переходим к описанию результата эксперимента по статье [2].
1. При напряжениях от 0,5 до примерно 1,45 вольта ток через электролизёр при постоянном напряжении не сохраняется постоянным, а постепенно уменьшается. Разложение воды (электролиз) при этом не происходит (см. рис. 2 а, 2 б, 2 в, позаимствованные из [2]).
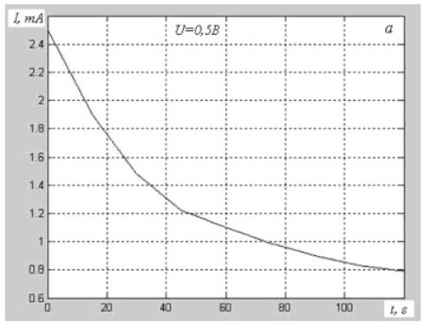
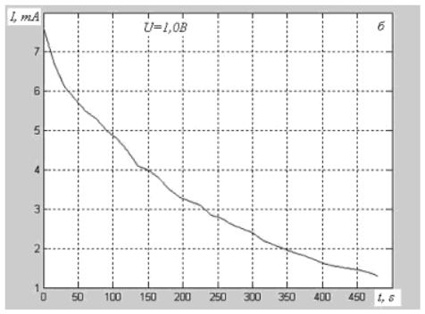
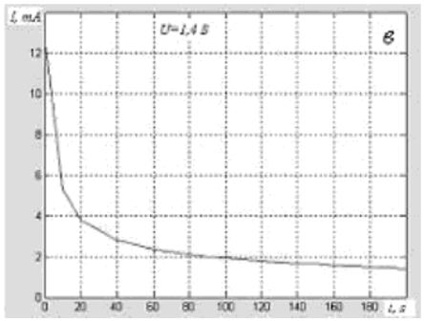
Авторы пишут: "Кривые изменения тока похожи на характеристики зарядного тока конденсатора, которые включают и составляющую сквозной проводимости через его диэлектрик". Они пишут "похожи", так как традиционно исходят из того, что электролит разделён на ионы. Если же понимать, что этого не может быть, то можно предположить, что они невольно привели экспериментальное доказательство того, что то, что мы принимаем обычно за электролит, т.е. за проводящую жидкость, на самом деле является жидким диэлектриком – по крайней мере, в описанном диапазоне напряжений. Можно считать, что ток при этом не течёт, по существу, через электролизёр, но при этом накапливается заряд на электродах, как на обкладках обычного конденсатора.
Авторы статьи [2] считают, что выделения газа (электролиза воды) в этом режиме нет, так как "потенциал электродов недостаточен для разряда ионов". Но это только слова. Что может помешать свободному иону соединиться с противоположным по знаку зарядом? Ничто. Авторы, разумеется, при этом деликатно обходят вопрос о том, что якобы диссоциированные ионы раствора должны были бы соединиться друг с другом.
Но авторы не одиноки в таком мнении. „Современные представления о проводимости диэлектрических жидкостей состоят в следующем. Здесь носителями заряда являются ионы, т.к. электроны легко прилипают к нейтральным молекулам жидкости и не могут существовать в свободном состоянии. Кроме того, в жидкости заряды могут переноситься молионами, макрочастицами и даже пузырьками. Ионизация облегчена по сравнению с газами за счет большей диэлектрической проницаемости. Рекомбинация носителей заряда в жидкости затруднена, поскольку заряды легко окружаются соседними молекулами, ориентированными соответствующими концами постоянных или индуцированных диполей к ионам.
Что касается подвижности, то она определяется движением жидкости. При этом подвижности любых ионов близки друг другу, т.к. ионы “вморожены” в жидкость и переносятся “микроструйками” жидкости." [3]
Но не является ли это мнение обычными ничем не подтверждёнными наукокорректными словесами?
2. При напряжении 1,45 вольт из щелочного раствора на одном из электродов начинает выделяться кислород (см. рис. 3, также позаимствованный из статьи [2]).
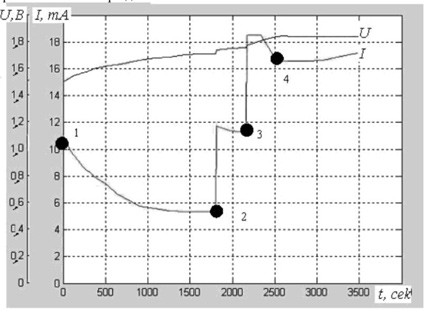
Рис. 3. Совмещённые характеристики напряжения U = f(t) и I = f(t) при приложениии ступенек напряжения на ячейку, где 1 – момент начала выхода кислорода; 2 – первое дополнительное увеличение напряжения питания; 3 - второе дополнительное увеличение напряжения питания; 4 - момент начала выхода водорода.
К сожалению, авторы статьи в этом случае не поддерживали постоянным напряжение. Но и при медленном поднимании напряжения величина тока падала.
- Можно ли эту ситуацию объяснить, попрежнему оставаясь на позиции раствора-диэлектрика?
- Да, можно. Выделение кислорода приводит к тому, что материал диэлектрика медленно меняется. Гидратированная щёлочь медленно заменяется на другой материал, в котором меньше содержание кислорода. Вследствие этого может увеличиваться ёмкость "конденсатора". Можно считать, что ток через раствор попрежнему не течёт. Происходит зарядка конденсатора.
- А как вы объясняете выделение кислорода именно при этом напряжении, но не раньше?
- Очень просто. Анод притягивает к себе электроны. Ядро кислорода держится за свои электроны. Когда сила притяжения анодом электронов превышает силу, с которой атом кислорода удерживается гидратированной молекулой щёлочи, происходит отрыв атома кислорода.
- Анод тянет с одной стороны, а гидратированная молекула щёлочи с другой, пока не происходит разрыв?
- Молекула слишком лёгкая, чтобы она была способна на такое. Кроме того, мы в такой ситуации придаём ей волю, желание, чего она иметь не может. В любой химической реакции участвует тепловое движение. Мне кажется, что можно представить следующую картину. Молекула притягивается анодом и удерживается им. По молекуле вследствие теплового движения ударяют другие гудратированные молекулы. При достаточной силе удара прилипшая молекула разрывается в самом слабом звене, а это оказывается именно в месте связи молекулы с атомом кислорода. Этот атом, находясь на поверхности анода, вступает в реакцию с другим атомом кислорода. Образуется молекула кислорода, связь которой с поверхностью анода уже относительно меньше и в результате теплового взаимодействия с молекулами раствора она отрывается от поверхности анода, образуя с другими молекулами кислорода пузырьки газа.
- И никакие электроны не остаются при этом на аноде, не проникают в него?
- Ионизация кислорода (отрыв электрона) требует значительно большего напряжения, около 14 эв [4]. Поэтому естественно, что молекула кислорода забирает свои электроны с собой.
3. - Ну, хорошо. Напряжение на электродах потихоньку поднимается и, наконец, достигло величины 1,85 вольт, при котором начинается выделения водорода (точка 4 на рис. 3). Величина тока значительно возросла и уже не уменьшается со временем. Теперь, какие бы доводы вы ни приводили, вам придётся признать, что через раствор течёт ток. Как вы теперь сможете обойтись без ионизации раствора?
- Мы достигли знаменательной точки 4 на графике рис. 3. Начиная с этой точки, действительно, уже нельзя назвать ток, поступающий на электроды электролизёра, зарядным. Он имеет какой-то иной смысл.
- Итак, ваша гипотеза о том, что электролит не разделён на ионы, рухнула?
- Как раз наоборот. Точка 4 неопровержимо доказывает её правильность.
- Вы шутите?!
- Нисколько. С этого момента на обоих электродах идут постоянные химические реакции - выделение кислорода и водорода. Вспомните, как представляются эти реакции.
В цитируемой статье [2] на аноде якобы происходит следующая реакция:
Два отрицательных иона и две молекулы воды отдают аноду четыре электрона e и превращаются при этом в молекулу кислорода и два положительных иона. Здесь выделяется кислород.
На катоде молекула воды якобы разрывается и превращается в протон p и отрицательный ион OH¯:
Протон p после этого якобы получает от катода электрон и становится водородом.
Так как никто не знает, что там происходит на самом деле, то реакции все пишут по разному, но суть их всегда одна и та же: на катоде некоторой группе А молекул и ионов якобы отдаются электроны, и они превращаются в некоторую группу Б из других молекул и ионов. На аноде группа Б отдаёт полученные электроны и превращается снова в группу А. Таким образом группа ионов при электролизе якобы переносит электроны с одного электрода на другой, осуществляя этим процесс протекания электрического тока. Следовательно, при начале выделения газа на обоих электродах ток питания электролизёра должен волей-неволей резко возрасти.
Посмотрите теперь внимательно на рис. 3. В точке 4 при начале выделения водорода ток нисколько не возрос. Это означает, что никакие дополнительные электроны при начале этого процесса в так называемый электролит не передаются! Следовательно, никаких ионов в растворе нет!
Получается очень странная ситуация: ток, протекающий через электролизёр, не имеет никакого отношения к процессу электролиза. Он, конечно, всё-таки нужен, но только как метод создания определённого напряжения на электродах или разности потенциалов в приэлектродном слое «электролита».
4. Перейдём теперь к гальваническим элементам. На рис. 4 показана схема медно-цинкового гальванического элемента (элемент Даниэля-Якоби). В нём якобы происходит следующая реакция [5]
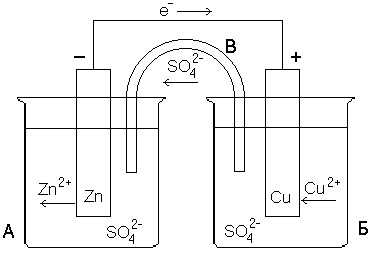
Рис. 4. Конструкция медно-цинкового гальванического элемента (элемент Даниэля-Якоби) [5]
То есть, цинковый катод (находящийся под отрицательным потенциалом) отбирает у атома Zn два электрона, тот переходит в раствор и становится ионом Zn2+, в районе анода ион меди Cu2+ получает эти два электрона , в результате чего он становится нейтральным и осаждается на аноде.
- Красиво и логично?
- Да, на первый взгляд это кажется очень логичным. Но я утрировал ситуацию. Она невозможна. По описанию и по рисунку ионы Zn2+ были и остаются в банке слева, а ионы Cu2+ были и остаются в банке справа. По согнутой трубке, объединяющей своими концами электролиты обеих банок, текут только отрицательно заряженные ионы SO42–. Формула реакции (1) ничто иное, как трюк фокусника.
Написанием этой формулы фокусник делает вид, как будто исходные продукты Zn и CuSO4 (первая половина равенства) находятся вместе (в одном и том же сосуде). Но они в разных сосудах и никогда не встречаются. Что же тогда означает знак (+)?
Конечные продукты, ZnSO4 и Cu, также объединены в формуле (1) знаком (+). Но они тоже находятся в разных сосудах и тоже никогда не встречаются. И здесь знак (+) совершенно непонятен или же совершенно неуместен.
Если здесь и выполняются формулы, то только формулы (2а) и (2б). Но это формулы растворения цинка и осаждения меди. Никакого замещения меди цинком здесь не наблюдается.
5. Все объяснения работы этого элемента не блещут логикой и им трудно поверить. Цинковый электрод обладает отрицательным зарядом и потому атомы цинка якобы переходят в раствор, становясь ионами — положительными (!). Как катод может отобрать у одного из своих атомов его электроны и затем вытолкнуть его в раствор? Для этого кто-то должен сидеть внутри катода и дать одному из атомов цинка хорошего пинка — удерживая при этом два его электрона! Обычно говорят, что отрицательно заряженный предмет передаёт часть заряда другому и тот тоже становится отрицательно заряженным. Здесь почему-то наоборот? Хуже того. Положительно заряженные ионы цинка притягиваются обратно катодом, но не переходят на него и даже не разряжаются. Почему? А им нельзя.
У анода происходят аналогичные чудеса. Здесь положительно заряженные ионы меди притягиваются анодом (положительно заряженным !) и спокойно осаждаются на нём. Почему? А им можно.
Перейдём теперь к началу процесса, к созданию элемента. Мы имеем две банки с нейтральным раствором. Пусть они соединены U-образным мостиком, как на рис. 4. Теперь мы погружаем в раствор электрически нейтральные электроды. И элемент, разумеется, заработал! На электродах появилось напряжение. А ведь не должен бы? Описание всех реакций держится на уже существующем напряжении на электродах. А здесь-то его не было. Элемент не должен был заработать?
Кругом одни неувязки. Описанию принципа действия элемента верить абсолютно невозможно. Что-то здесь не так.
6. Зададимся теперь вопросом: а нужны ли вообще ток и напряжение для протекания реакции (1)? Оказывается, нет. В очень интересной статье [6] своего рода начальный процесс описывается так:
«Что если оба металла погрузить в общий раствор, содержащий два вида ионов. Погрузить разумеется, можно, только обмен электронами будет на поверхности цинка, а не через внешнюю цепь. Цинк начнет растворятся постепенно покрываясь ямками, в тоже время покрываясь корочкой меди, которая сформирует губчатое коричневое покрытие».
Т.е. реакция может проходить без наличия тока и напряжения на одном и том же электроде?
Обратим теперь внимание на следующее. Напряжение в элементе Даниэля-Якоби нужно вовсе не для протекания реакции (1), а для управления ею! При отсутствии тока, но наличии напряжения, реакция, по существу, останавливается.
- Ага, значит ток всё-таки нужен для протекания реакции!
- Только в данной конструкции и при данных растворах, помещённых в различных сосудах. Сама по себе реакция (1), как мы только что видели, может протекать в одном сосуде без наличия электрических токов и на одном и том же «электроде». Можно ли поверить, что положительные ионы могут одновременно покидать поверхность металла (растворяться) и осаждаться на ней же? Такое можно представить в отношении нейтральных атомов или молекул, но никак не в отношении заряженных частиц (ионов). Например, на отрицательно заряженную поверхность могут осаждаться положительно заряженные частицы (ионы), но они никак не могут её покидать. Не следует ли отсюда вывод, что указанная реакция в одном из сосудов (по статье [6]) может протекать только в том случае, если те и другие частицы (атомы, молекулы) нейтральны? Т. е., никаких ионов цинка и меди в растворе не существует?
7. Из сказанного выше следует, что электрическое напряжение (разность потенциалов) в элементе Даниэля-Якоби возникает в момент погружения электродов в раствор. Но при отсутствии внешней цепи тока химическая реакция в нём (практически) не протекает! То есть, причиной появления напряжения является предположительно соответствующая концентрация различных химических материалов в левой и правой банках элемента. В левой банке желательна относительно низкая концентрация ZnSO4, а в правой, наоборот, достаточно высокая CuSO4. Но это вовсе не обязательное условие возникновения напряжения, а только условие достаточно долгой работы элемента.
- Все противоречия, казалось бы, разрешились, но мы стоим у разбитого корыта. Мы не знаем, как в этом элементе может протекать ток, если раствор не содержит ионов.
- Эта проблема висела в воздухе с самого начала нашего обсуждения. Она едва ли не главная наша тема. Авторы статьи [2], с которой мы начали обсуждение, сообщают следующее:
«Тот факт, что электроны могут покидать электрод и участвовать в формировании тока через раствор, был подтверждён экспериментально. Например, при прохождении тока через этиловый спирт напряжение между электродами в сто раз превышало напряжение разложения воды, площадь катода обеспечивала плотность тока, в 5 раз превышающую минимально необходимую для выделения водорода. Тем не менее никаких процессов на электродах не было обнаружено, из-за чего и возникла версия чисто электронной проводимости».
О чём здесь идёт речь? О так называемых свободных электронах, якобы обеспечивающих проводимость? Но эта идея и для металлов практически необоснованна. В случае же жидкости её обосновать ещё труднее.
Известно явление под названием «мостик из воды» [7] , где ток под напряжением 30 киловольт (!) течёт по дистиллированной воде. О том, что при этом происходит или не происходит разложение (электролиз) воды, в публикациях о «мостике» не сообщается. Эта работа чисто экспериментальная, авторы её меньше всего интересуются вопросом, почему ток течёт и что является носителем тока. Но этот вопрос должен интересовать нас.
- Нас должно интересовать не только это. Хотелось бы знать более подробно, как же всё-таки возникает напряжение. Ссылка на концентрацию определённых химических материалов, на мой взгляд, слишком туманна.
- Согласен с вами. Но знаем ли мы хотя бы один случай возникновения э.д.с., который дал бы нам полную ясность? Возьмите самое известное нам — возникновение тока в электромагнитных генераторах. Там всё сводится к тому, что на движущийся в магнитном поле электрон действует некая сила. Это тоже только толкование экспериментального факта. Почему эта сила возникает, мы никогда не знали. Но мы никогда не спрашиваем об этом. Мы знаем, что в этих условиях возникает э.д.с., и удовлетворяемся этим знанием. Мы просто привыкли к этому факту.
- Знаете, мне кажется, что результат нашего обсуждения довольно-таки отрицательный. Мы, возможно, убедились в том, что молекулы в жидкости не диссоциируют на ионы. Но большей ясности вопроса мы явно не добились.
- В пользу отсутствия ионов можно привести ещё один аргумент. Рассмотрим зависимость времени разряда от величины разрядного тока [8]. Если бы ток определялся потоком ионов, появляющихся в результате описанной выше реакции, то время разряда, хотя бы в первом приближении, должно было бы быть обратно пропорционально силе тока, т. е. произведение: сила тока на время разряда должно было бы быть примерно постоянным.
Т.е. ёмкость гальванического элемента должна была бы быть примерно пропорциональна расходу материала в ней, растворению определённого количества цинка или осаждению определённого количества меди. Ясное дело, что эта величина никак не может зависеть от режима разряда элемента. На самом деле ничего этого нет.
Это означает, что расход материала не соответствует электрической ёмкости элемента. Другими словами, ток элемента не пропорционален числу атомов осаждаемого или растворяемого материала. И, следовательно, здесь также, как и в случае с электролизом, не может быть речи об ионах.
Как раз этот факт в обоих рассмотренных нами случаях ставит вопрос о том, за счёт чего обеспечивается прохождение тока. Этот факт указывает на наше незнание, наше непонимание. Возможно, этот вывод более важный, чем вывод о том, что жидкости не диссоциируют на ионы.
8. Я несколько иначе смотрю на результаты нашего обсуждения. Мы не только убедились в том, что в жидкостях нет никакого разложения молекул на ионы, что само по себе уже положительно, как исправление неправильного мнения. Биологи смогут теперь иначе, более правильно, взглянуть на химические реакции, протекающие в клетках. Само по себе это уже прогресс. И не только биологи, но и все, кто имеет дело с химией или физикой растворов жидкостей, могут теперь смотреть на происходящее под совершенно иным углом зрения.
Вспомним, кроме того, о магнитных аномалиях, обычно объясняемых наличием магнитных руд. Имея иное объяснение для возникновения электрического напряжения в элементе Даниэля-Якоби, мы можем предположить, что магнитные аномалии могут возникать и от наличия немагнитных руд. А это, какая-никакая, а подсказка для геологов. То есть, мы имеем не только теоретический, но и непосредственный практический выход из нашего доказательства.
|
|