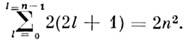Все известные хим. элементы образуют 8 вертикальных столбцов - групп (табл.), обозначаемых римскими цифрами, все группы состоят из двух подгрупп - а и б (напр., VII группа делится на подгруппу марганца и подгруппу галогенов); иногда подгруппы а и б наз. главной и побочной соответственно. Номер группы в П. с. э. соответствует высшей положит. валентности элемента. Свойства элементов в подгруппах а изменяются закономерно. Так, в подгруппе щелочных металлов (I a)увеличение ат. номера Z сопровождается повышением химической активности, тогда как в подгруппе галогенов (VII а)наблюдается обратная зависимость.
Горизонтальные ряды П. с. э. наз. периодами (их 7) и обозначаются араб. цифрами. Внутри каждого периода наблюдается б. или м. равномерный переход от активных металлов через менее активные металлы и слабоактивные неметаллы к очень активным неметаллам и, наконец, к инертным газам.
В каждом периоде, начиная с 4-го, между II и III группами находятся ряды переходных элементов - металлов со сходными хим. свойствами. 15 переходных элементов 6-го периода, начиная с лантана, практически не различимые по свойствам, наз. лантаноидами или редкоземельными элементами. В 7-м периоде также имеется ряд очень сходных металлов - актиноидов.
Структура П. с. э. полностью отвечает порядку заполнения электронных оболочек и слоов в атомах. Число хим. элементов в периоде равно числу электронов в слое, к-рое определяется в соответствии с Паули принципом ,запрещающим существование в атоме электронов в одинаковом квантовом состоянии. Состояние электрона определяют 4 квантовых числа: главное квантовое число п = 1, 2, 3,..., орбитальное (азимутальное) квантовое число l = 0, 1, 2, ..., п - 1, магн. квантовое число ml = 0,
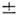 1,
1,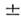 2,
...,
2,
...,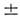 l и
спиновое квантовое число ms =
l и
спиновое квантовое число ms =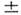 1/2.
Каждому значению l соответствуют 2l + 1 значений ml,
а каждому значению ml - 2 возможных значения ms.
Т. о., замкнутая оболочка, характеризуемая определёнными значениями п и
l, содержит 2(2l + 1) электронов. Макс. число электронов
в слое с определённым п равно:
1/2.
Каждому значению l соответствуют 2l + 1 значений ml,
а каждому значению ml - 2 возможных значения ms.
Т. о., замкнутая оболочка, характеризуемая определёнными значениями п и
l, содержит 2(2l + 1) электронов. Макс. число электронов
в слое с определённым п равно: