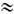 1) и слабых (a<<1) Э. Один и тот же Э. в разных растворителях может образовывать
растворы с разной a.
1) и слабых (a<<1) Э. Один и тот же Э. в разных растворителях может образовывать
растворы с разной a.Электролиты - жидкие и твёрдые вещества, обладающие ионной проводимостью, т. е. проводники, в к-рых
электрич. ток обусловлен движением ионов (проводники 2-го рода). Электрич;
ток в Э. сопровождается хим. реакциями на электродах(см. Электролиз ).В
нек-рых случаях наблюдается смешанная электропроводность - электронно-ионная
(напр., в растворах щелочных металлов в жидком NH3); высокой проводимостью
обладают Э. с протонной проводимостью.
К жидким Э. относятся расплавы
солей (ионные жидкости), водные и неводные растворы солей, оснований и кислот,
к-рые, в свою очередь, часто называют Э. К твёрдым Э. относятся ионные кристаллы
с дефектами кристаллич. структуры с низкой ионной проводимостью (до 10-10
Ом.см ). К ним относятся также кристаллич. вещества, в к-рых подструктура
отдельных ионов (в отличие от подструктуры остальных ионов) разупорядочена и
электропроводность к-рых высока (см. Ионные суперпроводники ).К твёрдым
Э. относится и особый класс высокомолекулярных соединений - полиэлектролиты.
В твёрдых Э. проводимость иногда может быть обусловлена движением ионов только
одного знака (униполярная проводимость); к таким Э. относятся, напр., AgCl -
в проводимости участвуют только ионы Ag+ , ВаСl2 - только
ионы Cl-.
Наиболее широко применяются
и хорошо изучены водные растворы Э. Они входят в состав живых организмов и участвуют
во всех жизненно важных процессах. Свойства растворов Э. определяются степенью
электролитич. диссоциации a, к-рая возрастает с ростом диэлектрич. проницаемости
растворителя e. Поэтому для получения растворов Э. обычно используют полярные
жидкости с высокой e (вода, спирт и др.). По степени диссоциации условно различают
растворы сильных (a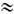 1) и слабых (a<<1) Э. Один и тот же Э. в разных растворителях может образовывать
растворы с разной a.
1) и слабых (a<<1) Э. Один и тот же Э. в разных растворителях может образовывать
растворы с разной a.
В полярных растворителях
в растворах Э. создаются т.н. с о л ь в а т н ы е с т р у к т у р ы - более
или менее устойчивые комплексы иона с ближайшими молекулами растворителя, обусловленные
межатомными взаимодействиями и межмолекулярными взаимодействиями. Между сольва-токомплексом и остальным раствором происходит непрерывный обмен
молекулами, частота к-рого определяется характером и прочностью связей (энергией
сольватации) в комплексе.
Электролитич. диссоциация
приводит к увеличению общего числа частиц в растворе, поэтому свойства разбавленных
растворов Э. отличаются от свойств обычных разбавленных растворов. Так,
происходит увеличение осмотич. давления раствора и отклонение от ур-ния Вант-Гоффа
(см. Осмос ),понижение давления пара растворителя над раствором и его
отклонение от Рауля закона ,возрастание температуры кипения и снижение температуры
замерзания раствора Э.
Весьма разбавленные растворы
слабых Э. по свойствам близки к идеальным растворам и описываются классич. теорией
электролитич. диссоциации. Свойства разбавленных растворов сильных Э. вследствие
межионных взаимодействий отличны от свойств идеальных растворов и описываются
теорией Дебая-Хюккеля. В рамках этой теории удовлетворительно объясняется концентрац.
зависимость коэффициентов активности ионов, осмотич. коэффициентов, электропроводности,
диффузии, вязкости, и др. При повышении концентрации сильных Э. необходимо учитывать
размеры ионов и влияние сольватации на межионные взаимодействия.
При росте концентрации
- в т.н. переходной области - структура раствора меняется, т. к. мн. молекулы
растворителя связаны с ионами Э. в сольватокомплексы. В области концентрированных
растворов их структура приближается к структуре соответствующих ионных расплавов
или даже кристаллов, что экспериментально подтверждено спектроскопическими и
нейтронографическими исследованиями.
К ионным проводникам, к-рыми
являются Э., применим Ома закон (для растворов Э.- за исключением областей
сильных электрич. полей и высоких частот). Удельная электропроводность у Э.
значительно ниже, чем у электронных проводников (обычно от 1 до 10-10
Ом.см-1).
В растворах Э. для характеристики
проводимости пользуются также параметром молярной электропроводности
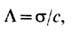
где s - уд. электропроводность
раствора, с-мол. концентрация раствора. В разбавленных растворах
сильных Э. а пропорциональна с, т. е. L практически постоянна. В более
концентрированных растворах сильных Э. L падает из-за роста межионных взаимодействий;
зависимость L от концентрации описывается ур-нием Онсагера:
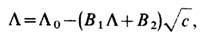
где B1
и В2 - функции температуры вязкости и диэлектрич. проницаемости
растворителя. В растворах слабых электролитов L падает с ростом с уже
в разбавленных растворах из-за уменьшения степени диссоциации Э.
В электрич. полях большой напряжённости (св. 104- 105 В/см) и в полях высокой частоты L резко возрастает, т. к. в этих случаях межионные и межмолекулярные взаимодействия значительно уменьшаются вследствие увеличения скорости ионов (см. также Химическая термодинамика).

|
|