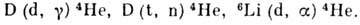
Дейтерий (от греч. deuteros-второй; лат. Deuterium), D или 2H,- тяжёлый стабильный изотоп
водорода с массовым числом 2; содержание в природном водороде 0,0156% (по массе).
Масса 2,0141018 а. е. м. Ядро Д.- дейтрон - состоит из 1 протона и 1
нейтрона. Д. открыт в 1932 Г. Юри (H. Urey) совм. с сотрудниками спектральным
методом.
Большое различие масс Д.
и протия (1H) обусловливает различие их свойств (изотопные эффекты).
Так, tкип вещества, состоящего из молекул D2, -23,57К,
межъядерное расстояние в молекуле D2-0,07416 нм, энергия диссоциации
D2 (при OK) 439,68 кДж/моль (ср. с соответствующими значениями для
H2 в ст. Водород ).Скорости химических реакций с участием
веществ, содержащих Д., могут быть в 5-10 раз выше или ниже, чем с участием
таких же веществ, содержащих протий.
Д. выделяют на основе различий
свойств протия и Д. Так, используют особенность изотопного обмена в системе
вода - сероводород, применяют ректификацию жидкого водорода, многоступенчатый
электролиз водных растворов и т. д.
Д. служит меченым стабильным
индикатором при проведении разл. хим., биохим. и др. исследований. Тяжёлая вода
D2O представляет собой лучший из известных замедлителей нейтронов.
В водородных бомбах используется гидрид лития 6LiD; при взрыве водородной
бомбы протекают термоядерные реакции:
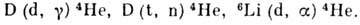
В будущем Д., возможно, станет основным ядерным топливом.
Дейтерий (тяжелый водород) D, стабильный изотоп водорода с мас. ч. 2, ат. м. 2,01416219. Ядро атома дейтерия - дейтрон состоит из одного протона и одного нейтрона, энергия связи между ними 2,23 МэВ. Поперечное сечение ядерной р-ции (n,g) 53.10-33 м2, поперечное сечение захвата тепловых нейтронов дейтронами 15.10-32 м2 (для протонов 3.10-29м2). Молекула двухатомна, длина связи 0,07417 нм; осн. частота колебаний атомов 3118,46 см-1; энергия диссоциации 440 кДж/моль, константа диссоциации К = p2D/pD2 = 4,173.10-73 (293,15 К). С др. изотопами водорода дейтерий образует молекулы протодейтерия HD (мол. м. 3,02205) и дейтеротрития DT (мол. м. 5,03034). В прибрежной морской воде соотношение D/(D + Н) составляет (155-156).10-6, в поверхностных водах - (132-151).10-6, в прир. газе - (110-134).10-6.
Свойства. Коэф. сжимаемости дейтерия (pV/RT)при 273,15 К: 1,0121 (2,0266 МПа), 1,0624(10,133 МПа), 1,130(20,266 МПа). С° [в Дж/(моль.К)]: 20,81 (20 К), 30,11 (100 К), 29,30 (298 К); теплопроводность 0,135 Вт/(м.К) (25 К); h 1,23.10-2 мПа.с (293,15 К). Дейтерий раств. в жидкостях (напр., в бензоле, толуоле, октане, гептане, ССl4, CS2) лучше, чем Н2, причем это различие возрастает с понижением т-ры.
Молекула D2 может находиться в орто- и пара-состояниях. Ортодейтерий (o-D2) имеет параллельную (одного знака) ориентацию ядерных спинов, а парадейтерий (п-D2) -антипараллельную. Это обусловливает нек-рое различие магн., оптич. и термич. св-в разл. модификаций. При обычных условиях D2 (нормальный дейтерий, н-D2) представляет собой
смесь 2/3 орто- и 1/3 пара-модификаций, к-рые могут взаимно превращаться друг в друга (орто-пара-превращение). Каждой данной т-ре соответствует определенный равновесный состав (равновесный дейтерий, p-D2). Так, доля п-D2 составляет: 0,333 (при 300 К), 0,251 (60 К), 0,148 (40 К), 0,019 (20 К). При низких т-рах термодинамически стабилен o-D2. Самопроизвольное орто-пара-превращение при низких т-рах происходит очень медленно, что позволяет получить жидкий дейтерий, близкий по составу к нормальному. Орто-пара-превращение ускоряется в присут. катализаторов (соед. Fe, Сr, Со, Мn, РЗЭ). Св-ва дейтерия приведены в табл. 1 и 2.

Ур-ние температурной зависимости давления пара над твердым и жидким дейтерием: lg 0,0075p (Па) = А - В/Т + СT (значения А, В и С приведены в табл. 3).

Теплота испарения o-D2 (в Дж/моль): 1202,9 (24,25 К), 1029,5 (30,53 К).
Твердый D2 имеет тетрагон, объемноцентрированную решетку, а = 0,338 нм, с = 0,560 нм; т. пл. 18,73 К. Н2 и D2 не изоморфны, обнаружена их ограниченная взаимная р-римость в твердом состоянии. При 4,2 К предельная р-римость D2 в Н2 ок. 10% по объему, а р-римость Н2 в D2 21%.
По хим. св-вам D2 аналогичен Н2, однако скорость р-ций при замещении Н на D заметно уменьшается, напр., при окислении орг. соед., взаимод. Н2 с Сl2 - в 5-10 раз. При электролизе воды D2 выделяется медленнее, чем Н2.
Важное практич. значение имеют р-ции изотопного обмена дейтерия. Константа равновесия р-ции Н2 + D2 D 2HD составляет: 1,345 (50 К), 2,903 (200 К), 3,44 (373,15 К), 3,80 (700 К). Осуществляют ее в присут. катализатора (Pt, Ni, РЗЭ). Для р-ции НDО(ж) + D2(г) D D2О(ж) + HD(г) (где ж -жидкость, г - газ) константа равновесия: 3,96 (223,15 К), 2,92 (323,15 К), 2,40 (373,15 К). Для р-ции Н2О(ж) + HD D НDО(ж) + Н2(г) константа равновесия: 4,69 (223,15 К), 3,37 (323,15 К), 2,69 (373,15 К). Изотопный обмен между водой и D2 или HD может протекать в паровой фазе в присут.
катализаторов (напр., Ni) или в жидкой под давлением (из-за плохой р-римости изотопов водорода в воде) в присут. катализаторов (в т. ч. гидрофобных) в гомог. или гетерог. системе. Нек-рые р-ции изотопного обмена Н протекают очень быстро, напр., в группах ОН (щелочи, спирты) и NH (NН3, амины).
Важнейшие соед. дейтерия- тяжелая вода D2O. Дейтериды соед., аналогичные гидридам. Большое практич. значение имеет дейтерид лития 6LiD - ocн. компонент заряда термоядерного (водородного) оружия.
Для аналит. определения дейтерия применяют масс-спектрометрич., спектральные, хроматографич., а также денсиметрические (путем измерения плотности) методы изотопного анализа.
Получение. Дейтерий выделяют гл. обр. из тяжелой воды, напр., электролизом, р-цией с металлами. Дейтерий получают также низкотемпературной ректификацией из электролитич. водорода или азотоводородной смеси для синтеза NH3 (водород к-рой содержит 250-300 м. д. HD). Исходный водород или азото-водородную смесь после тщательной очистки от примесей (О2 до 10-9 мольных долей, остальные газы - до 10-7-10-8 мольных долей) сжижают и двухступенчатой ректификацией при 22-24 К выделяют конц. HD. Последний в присут. катализатора превращается в смесь Н2 + D2 + HD, из к-рой низкотемпературной ректификацией получают 99,8%-ный D2. Сжиганием с воздухом или О2 последний переводят в тяжелую воду.
Применение. Дейтерий (в виде D2О) - замедлитель нейтронов в ядерных реакторах. Дейтроны, обычно получаемые путем ионизации атомов дейтерия, используются в качестве бомбардирующих частиц в ядерных р-циях, в частности для получения быстрых нейтронов. Дейтерий применяется также как изотопный индикатор в научных исследованиях в химии, биологии, физиологии, агрохимии и др. (в т.ч. в опытах с живыми организмами и при диагностич. исследованиях человека). Соед. дейтерия используются также при спектроскопич. исследованиях. Изделия из монокристаллов на основе KD2PO4 применяются для создания систем управления и преобразования лазерного излучения. Дейтерий - ядерное топливо для энергетики будущего, основанной на управляемом термоядерном синтезе. В первых энергетич. реакторах такого типа предполагается осуществить р-цию D + T D He + n + 17,6 МэВ.
Дейтерий открыт Г. Юри с сотрудниками в 1932.
===

|
|