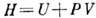 . Из условия постоянства
H следует, что изменение температуры T на единицу давления (дифференциальный
Д.-T. э.) равно
. Из условия постоянства
H следует, что изменение температуры T на единицу давления (дифференциальный
Д.-T. э.) равноДжоуля - Томсона эффект - изменение температуры газа при стационарном адиабатич. протекании его через пористую
перегородку. Обнаружен и исследован Дж. П. Джоулем и У. Томсоном (W. Thomson)
в 1852-62. В процессе Джоуля-Томсона газ, к-рый первоначально занимал объём
V1 при давлении P1, перетекает через пористую
перегородку, занимая после перехода объём V2 при давлении
P2. Над системой совершается работа P1V1-P2V2,
равная изменению внутр. энергии газа U2-U1, поскольку пористая перегородка гасит все его макроскопич. движения. Следовательно,
при протекании газа в условиях тепловой изоляции остаётся постоянной энтальпия
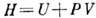 . Из условия постоянства
H следует, что изменение температуры T на единицу давления (дифференциальный
Д.-T. э.) равно
. Из условия постоянства
H следует, что изменение температуры T на единицу давления (дифференциальный
Д.-T. э.) равно
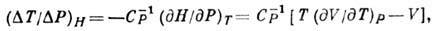
где 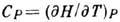 - теплоёмкость при пост. давлении. Назв. "дифференциальный" означает
малость величин
- теплоёмкость при пост. давлении. Назв. "дифференциальный" означает
малость величин 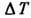 и
и 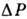 .
.
Для идеального газа Д.-T.
э. равен нулю, а для реальных газов его знак зависит от знака выражения 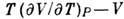 , к-рый определяется ур-нием состояния. Если при протекании газа через пористую
перегородку темп-pa убывает,
, к-рый определяется ур-нием состояния. Если при протекании газа через пористую
перегородку темп-pa убывает, 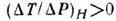 , то Д.-T. э. наз. положительным, если же темп-pa возрастает,
, то Д.-T. э. наз. положительным, если же темп-pa возрастает, 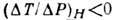 , то Д.-T. э. наз. отрицательным. Темп-pa Ti, при к-рой Д.-T.
э. меняет знак, наз. температурой инверсии. Совокупность точек инверсии на диаграмме
P, T наз. кривой инверсии (рис.). Данному давлению P соответствуют
две точки инверсии, между к-рыми Д.-T. э. положителен. Для большинства газов
(кроме H и Не) верхняя точка
, то Д.-T. э. наз. отрицательным. Темп-pa Ti, при к-рой Д.-T.
э. меняет знак, наз. температурой инверсии. Совокупность точек инверсии на диаграмме
P, T наз. кривой инверсии (рис.). Данному давлению P соответствуют
две точки инверсии, между к-рыми Д.-T. э. положителен. Для большинства газов
(кроме H и Не) верхняя точка 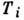 лежит
выше комнатной температуры. Для газа, описываемого Ван-дер-Ваальса уравнением, Д.-T. э. положителен, если
лежит
выше комнатной температуры. Для газа, описываемого Ван-дер-Ваальса уравнением, Д.-T. э. положителен, если 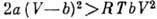 , где R - газовая постоянная, т. е. константы ур-ния Ван-дер-Ваальса
а и b оказывают противоположное влияние на знак Д.-T. э., к-рый
определяется конкуренцией сил отталкивания и сил притяжения между молекулами.
Кривая инверсии для газа Ван-дер-Ваальса соответствует ур-нию
, где R - газовая постоянная, т. е. константы ур-ния Ван-дер-Ваальса
а и b оказывают противоположное влияние на знак Д.-T. э., к-рый
определяется конкуренцией сил отталкивания и сил притяжения между молекулами.
Кривая инверсии для газа Ван-дер-Ваальса соответствует ур-нию 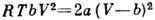 или в приведённых переменных
или в приведённых переменных 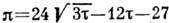 ,
где
,
где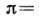
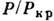 - приведённое давление,
- приведённое давление, 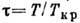 -
приведённая темп-pa,
-
приведённая темп-pa,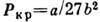 -
критич. давление, Ткр=
-
критич. давление, Ткр=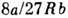 - критическая температура.
- критическая температура.
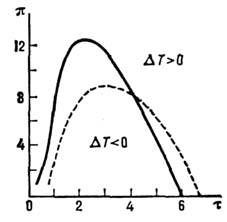
Кривая инверсии для дифференциального
Д.-T. э. в приведённых переменных 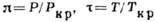 .
Сплошная кривая соответствует газу Ван-дер-Ваальса, пунктирная - экспериментальным
данным для H,.
.
Сплошная кривая соответствует газу Ван-дер-Ваальса, пунктирная - экспериментальным
данным для H,.
В процессе Джоуля-Томсона
энтропия возрастает, это необратимый процесс. Д.-T. э.- один из осн. способов
получения низких температур. Обычно для этой цели применяют Д.-T. э. в комбинации
с адиабатич. расширением газа. Дифференциальный Д.-T. э. невелик, для воздуха
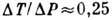 град/атм
град/атм 0,25*10-5
град/Па. В технике используют интегральный Д.-T. э., при к-ром давление изменяется
в широких пределах. Измерение
Д.-T. э. позволяет установить ур-ние состояния реального газа.
0,25*10-5
град/Па. В технике используют интегральный Д.-T. э., при к-ром давление изменяется
в широких пределах. Измерение
Д.-T. э. позволяет установить ур-ние состояния реального газа.

Д. H. Зубарев
|
|