
Энтальпия (от греч. enthalpo- нагреваю) (теплосодержание, тепловая функция Гиббса)- потенциал термодинамический, характеризующий состояние макроскопич. систем в термодинамич. равновесии при выборе в качестве осн. независимых переменных энтропии S и давления р. Термин "Энтальпия" ввёл X. Камерлинг-Оннес (Н. Kamerlingh-Onnes). Обозначается Н (S, p, N, xi ), где N-число частиц системы; xi- др. макроскопич. параметры системы. Энтальпия - аддитивная функция, т. е. энтальпия всей системы равна сумме энтальпий составляющих её частей. Энтальпия связана с внутренней энергией U системы соотношением:

где V-объём системы. Полный дифференциал энтальпии (при неизменных N и xi )имеет вид:

Из формулы (2) можно определить температуру Т, объём V и теплоёмкость ср системы:
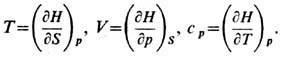
Эти свойства энтальпии при постоянном р аналогичны свойствам внутренней энергии при постоянном V:
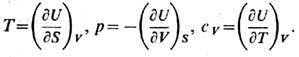
Равновесному состоянию системы при постоянных S и р соответствует мин. значение энтальпии. Изменение энтальпии (DH), равно количеству теплоты, которое сообщают системе или отводят от неё при постоянном давлении, поэтому значения DН характеризуют тепловые эффекты фазовых переходов (плавления, кипения и т. д.), химических реакций и других процессов, протекающих при постоянном давлении. В теплоизолированной системе при постоянном р энтальпия сохраняется, поэтому её называют иногда теплосодержанием или тепловой функцией (условие сохранения энтальпии. лежит, в частности, в основе эффекта Джоуля - Томсона).

Д. Н. Зубарев.
Когда тот или иной физик использует понятие "физический вакуум", он либо не понимает абсурдности этого термина, либо лукавит, являясь скрытым или явным приверженцем релятивистской идеологии.
Понять абсурдность этого понятия легче всего обратившись к истокам его возникновения. Рождено оно было Полем Дираком в 1930-х, когда стало ясно, что отрицание эфира в чистом виде, как это делал великий математик, но посредственный физик Анри Пуанкаре, уже нельзя. Слишком много фактов противоречит этому.
Для защиты релятивизма Поль Дирак ввел афизическое и алогичное понятие отрицательной энергии, а затем и существование "моря" двух компенсирующих друг друга энергий в вакууме - положительной и отрицательной, а также "моря" компенсирующих друг друга частиц - виртуальных (то есть кажущихся) электронов и позитронов в вакууме.
Однако такая постановка является внутренне противоречивой (виртуальные частицы ненаблюдаемы и их по произволу можно считать в одном случае отсутствующими, а в другом - присутствующими) и противоречащей релятивизму (то есть отрицанию эфира, так как при наличии таких частиц в вакууме релятивизм уже просто невозможен). Подробнее читайте в FAQ по эфирной физике.
|
|