Вода - простейшее
устойчивое хим. соединение водорода и кислорода (окись водорода - H2O),
при нормальных условиях - бесцветная (голубоватая в толстых слоях) прозрачная
жидкость без запаха. Одно из самых распространённых соединений в природе, играющее
исключительно важную роль в процессах, происходящих на Земле. Молекулы воды зарегистрированы
также в межзвёздном пространстве, она входит в состав комет, больших планет
Солнечной системы и их спутников, обнаружена на Марсе и Венере.
Известно 3 изотопа водорода
(1H - протий; 2H, или Д,- дейтерий; 3H, или
Т,- тритий) и 6 изотопов кислорода (14O, 15O, 16O,
17O, 18O и 19O), так что существует большое
кол-во изотопных разновидностей молекул воды. В природной воде на 105
атомов H приходится 15 атомов 2H, а на 104 атомов 16O
- 20 атомов 18O и 4 атома 17O. Остальные изотопы H и О
радиоактивны. Свойства т. н. тяжёлой воды D2O (др. "тяжёлые"
изотопные разновидности молекул воды обычно к этому термину не относят) сильно
отличаются от свойств природной воды (см. ниже). Тяжёлая вода применяется в промышленности,
технике и научных исследованиях. Наряду с тяжёлой водой в физ., хим. и биол. экспериментах
используется вода, содержащая T, 18O и 17O (в частности,
в колебательной и ЯМР-спектроскопии, нейтронографии и др.). Свойства воды, содержащей
тяжёлые изотопы О, не так резко, как для D2O, отличаются от свойств
обычной воды. Молекула воды представляет собой равнобедренный треугольник с ядрами
О и H в вершинах. Ниже приведены нек-рые характеристики молекулы воды (в основном
состоянии):
|
Молекулярная масса |
18,01 |
||
|
Межатомное расстояние
О-H |
0,0957 нм |
||
|
Валентный угол
H-О-H |
104,5° |
||
|
|
|||
|
Ix |
2,938*10-40
г*см2 |
||
|
Iy |
1,919*10-40
г*см2 |
||
|
Iz |
1,022*10-40
г*см2 |
||
|
Дипольный момент |
1,855 Д |
||
|
Cp. электрич. квадрупольный
момент |
5,6*10-26
ед. СГСЭ |
||
|
Энергия ионизации |
12,6 эВ |
||
|
Сродство к протону |
7, 1 эВ |
||
Физические свойства
воды. Вода может существовать в твёрдом (лёд), жидком и газообразном состояниях.
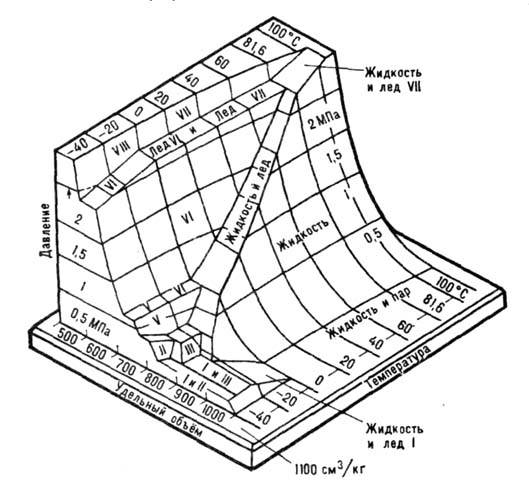
Области существования разл. фаз воды показаны на диаграмме (рис. 1). Физ.
свойства воды своеобразны. Так, при атм. давлении плавление
льда воды сопровождается уменьшением
объёма на 9% (рис. 2); коэф. термич. расширения льда (модификации Ih, см.
ниже) в интервале 0-63 К и жидкой воды до 3,98 0C отрицателен (рис.
3). Теплоёмкость ср жидкой воды почти вдвое выше, чем твёрдой
и газообразной, и в интервале температур 0- 100 0C почти не зависит от
температуры (имеется очень пологий минимум при 35 0C). Минимум изотермич.
сжимаемости наблюдается при 46 0C (рис. 4). Не совсем обычна зависимость
вязкости жидкой воды от давления: в области сравнительно низких давлений при темп-pax
до 30 0C вязкость с ростом давления уменьшается. Молекула воды - полярная,
и жидкая вода, и лёд являются диэлектриками.
Вода диамагнитна. Свойства воды зависят
от её изотопного состава. Так, давление пара D2O при 20 0C
на 13% ниже, чем пара H2O; при 222 0C значение давлений
для них одинаковы, а при более высоких темп-pax давление пара D2O
выше, чем для H2O. Ниже приведены значения нек-рых физ. величин для
обычной и тяжёлой воды в газообразном, жидком и твёрдом (лёд Ih) состояниях
при атм. давлении (кроме критич. параметров):
|
|
H2O |
D2O |
||
|
Плотность |
|
|
||
|
лёд при 00C |
0,917 г /см3 |
1,017 г/см3 |
||
|
жидкость при 200C |
0,9982 г/см3 |
1,1053 г/см3 |
||
|
Вязкость при 200C |
1,005 спз |
1,251 спз |
||
|
Темп-pa плавления |
273, 16 К (00C) |
276,97 К (3,8150C) |
||
|
Темп-pa кипения |
373, 16 К (1000C) |
374,59 K(101, 430C) |
||
|
Критич. темп-pa |
647,3 К (374, 150C) |
643,9 К (370,70C) |
||
|
Критич давление |
22,06 МПа |
21,67 МПа |
||
|
Критич плотность |
0,322 г/см3 |
0,356 г/см3 |
||
|
Теплота плавления |
332,4 Дж/г |
316,6 Дж/г |
||
|
Теплота кипения |
2256,2 Дж/г |
2070,9 Дж/г |
||
|
Теплота сублимации
льда при 00C |
2833,9 Дж/г |
2639,6 Дж/г |
||
|
Уд. теплоемкость
(Cp) |
|
|
||
|
лёд при 00C |
2,038 Дж/г* К |
2,202 Дж/г*К |
||
|
жидкость при 00C |
4,186 Дж/г* К |
4,23 Дж/г*К |
||
|
пар при 00C |
1,905 Дж/г*К |
1,68 Дж/г*К |
||
|
Диэлектрич. проницаемость |
|
|
||
|
лёд при - 100C |
95 |
92 |
||
|
жидкость при 250C |
78,54 |
78,25 |
||
|
|
|
|||
|
лёд при 00C |
234,6 мВт/м*К |
- |
||
|
жидкость при 00C |
560,9 мВт/м*К |
559,5 мВт/м*К |
||
|
жидкость при 1000C |
678,6 мВт/м*К |
644,4 мВт/м*К |
||
|
пар при 1000C |
25,1 мВт/м*К |
- |
||
|
Адиабатич сжимаемость
при 200C |
4,555*10-12м2/Н |
4,70*10-12
м3/Н |
||
|
Время диэлектрич.
релаксации |
|
|
||
|
лёд при -100C |
6*10-5
с |
9, 1*10-5
с |
||
|
жидкость при 250C |
9,22*10-13
с |
11,89*10-12
с |
||
|
Молекулярная магн
восприимчивость при 200C |
-12,972*10-6 |
- 12,948*10-6 |
||
|
Поверхностное натяжение
жидкой воды |
|
|
||
|
при 00C |
74,64*10-3
Н/м |
- |
||
|
при 200C |
72,75*10-3
Н/м |
72,57 *10-3
Н/м |
||
|
при 1000C |
58,89 10-3
Н/м |
58, 85*10-3
Н/м |
||
|
Показатель преломления
при 200C |
1,333 |
1,328 |
||
Благодаря высоким теплоёмкости, теплоте плавления и испарения, а также особенности зависимости плотности от температуры, Вода является важным регулятором и стабилизатором климатич. условий на Земле. Высокая диэлектрич. проницаемость, большой дипольный момент молекулы, обеспечивающие хорошую растворимость в воде мн. веществ, широкий температурный интервал существования жидкого состояния наряду с распространённостью воды обусловливают её широкое применение для мн. технол. процессов.

Рис. 1. Фазовая трёхмерная
диаграмма воды. Показаны области температуры
и давлений существования и сосуществованияразличных
фаз и их удельные объёмы.
Структура воды. Поскольку молекулы воды - полярные и обладают значит. дипольным моментом, они сильно взаимодействуют друг с другом и с др. полярными молекулами. Атомы H молекулы воды могут образовывать водородные связи с атомами кислорода, фтора, азота и нек-рыми др. атомами. Водородная связь изменяет геометрию и электронную конфигурацию молекулы воды: длины связей О-H и валентные углы Н-О-H увеличиваются. В результате дипольный момент растёт, полосы в колебательных спектрах, обусловленные валентными и деформац. колебаниями, сдвигаются в низкочастотную область и уширяются. В водяном паре при невысоких давлениях и умеренных темп-pax присутствует небольшое кол-во (ок. 1% при температуре кипения и атм. давлении) димеров - систем, состоящих из двух молекул воды. Энтальпия образования димеров (Н2О)2~3,6 ккал/моль (~15 кДж/моль), расстояние между атомами кислорода в них ~0,3 нм. В конденсир. фазах каждая молекула воды может участвовать в четырёх водородных связях: в двух в качестве донора протона и в двух - в качестве акцептора.
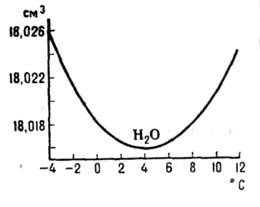
Рис. 2. Температурная зависимость
молярного объема жидкой воды при атмосферном давлении в области её максимальной
плотности.
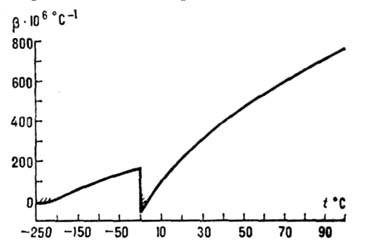
Рис. 3. Температурная зависимость
коэффициента 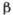 термического расширения льда Ih и жидкой воды (при атмосферном давлении).
Заштрихованные участки - области отрицательных значений коэффициента
термического расширения льда Ih и жидкой воды (при атмосферном давлении).
Заштрихованные участки - области отрицательных значений коэффициента 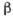 .
.
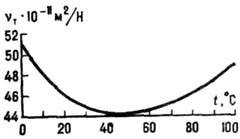
Рис. 4. Температурная зависимость
коэффициента изотермической сжимаемости для жидкой воды при атмосферном
давлении.
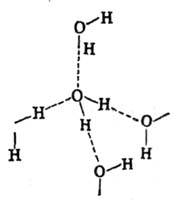
Рис. 5. Тетраэдрическая
координация молекул воды в конденсированных фазах. Показана одна из многих возможных
ориентации молекул.
Известно 10 модификаций
льда (табл.), существует также аморфный лёд.
|
Симметрия кристаллов
и плотность льда |
|||||
|
Модификация |
Сингония и пространственная
группа |
Плотность (г/см3) |
|||
|
при 98 К и атм.
давлении |
в области стабильного
существования * |
||||
|
Ih |
гексагональная,
Р63/ттс |
0,94 |
0,917 (273;0) |
||
|
Ic |
кубическая, |
0,94 |
0,93 (140;0) |
||
|
II |
тригональная, |
1, 17 |
1,18 (240; 2,1) |
||
|
III |
тетрагональная,
P41212 |
- |
1,15 (251,2) |
||
|
IV |
тригональная, |
1,27 |
- |
||
|
V |
моноклинная, А2/а |
1,23 |
1,26 (268,8) |
||
|
VI |
тетрагональная,
Р42/птс |
1,31 |
1,34 (288,8) |
||
|
VII |
кубическая, 1m3m |
- |
1,65(298,25) |
||
|
VIII |
" |
1,50 |
1,66(223,25) |
||
|
IX |
тетрагональная |
1,14 |
- |
||
* Лёд IV является метастабильной фазой в области стабильного существования льда V; лёд IX -упорядоченный по ориентациям молекул вариант льда III, а лёд VIII-льда VII; в скобках темп-pa в К и давление в кбар.
Из структурных исследований
кристаллич. модификаций льда и кристаллогидратов (органич. и неорга-нич. кристаллов,
в состав к-рых входят молекулы воды)
известно, что ср.
расстояние О. . .О составляет ~0,28 нм, а угол О-H...О в наиб. энергетически
выгодной конфигурации 180°. Четыре водородные связи молекулы воды направлены
приблизительно к вершинам правильного тетраэдра (рис. 5). В кристаллогидратах
довольно часто встречаются
молекулы воды, участвующие в трёх водородных связях: в двух - в качестве донора
и в одной - акцептора. Во всех модификациях льда система водородных связей между
молекулами представляет собой трёхмерную сетку (рис. 6). В гексагональной и
кубической модификациях, существующих при низких давлениях (льды Ih и Ic), все
связи практически прямолинейны и каждая молекула окружена четырьмя другими,
находящимися в вершинах правильного тетраэдра. Расположение атомов кислорода
в них такое же, как углерода в алмазе (лёд I с) и лонсдейлите (лёд Ih).
В модификациях, устойчивых при высоких давлениях (кроме льдов VII и VIII), связи
искривлены (углы О-H. . .0 меньше 180°) и углы между ними заметно отличаются
от тетраэдрич. (109°28'). В самых плотных модификациях VII и VIII две неискажённые
сетки, такие же, как во льду Iс, вставлены одна в другую. В структуре
льда VI также можно выделить две вставленные друг в друга сетки, но связи в
них сильно искривлены, а окружение молекул заметно отличается от её окружения
при идеально тетраэдрической структуре. Все модификации льда (кроме II, VIII
и IX) ориентационно разупорядочены. Каждая молекула воды в них может быть ориентирована
одним из шести способов (по числу рёбер тетраэдра), за счёт чего кристаллы этих
модификаций обладают
остаточной энтропией, т. е. при абс. нуле температур сохраняется нек-рая разупорядоченность.
Низкочастотная диэлектрич. проницаемость ориентационно разупорядоченных модификаций
высока (100 и выше), а упорядоченных - низка (~ 3).
Рис. в. Структура обычного (1h) льда.
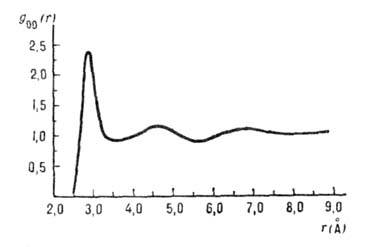
Рис. 7. Парная корреляционная
функция gОO межатомных расстояний О.
. .О(r) в жидкой иоде (плотность вероятности расстояний r между
атомами О).
Эксперим. данные, полученные
с помощью рентгеновского структурного анализа, нейтронографии, колебат. спектроскопии,
ЯМР, рассеяния света, термодинамич. методов, исследования диэлектрич. релаксации
и др., позволяют утверждать, что трёхмерная приближённо тетраэдрич. сетка водородных
связей существует и в жидкой воды во всём интервале температур и давлений. Это, в
частности, следует из анализа парной корреляционной функции расстояний
О. . .О (рис. 7), построенной на основании нейтронографич. и рентгенографич.
исследований. Положение первого максимума и площадь под ним говорят о том, что
каждая молекула в ср. окружена менее чем пятью др. молекулами, находящимися
на расстоянии, близком к длине водородной связи, а положение второго максимума
(~4,5 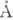 ) соответствует
длине ребра тетраэдра вокруг молекулы воды (рис. 5). Эти данные трудно согласовать
с существующими моделями воды, допускающими наличие в ней ассоциатов, групп, кластеров
(в к-рых молекулы соединены водородными связями), разделённых несвязанными молекулами.
По-видимому, ближе к реальности т. н. клатратные модели (наиб. известная из
них - модель, предложенная О. Я. Самойловым в 1946), постулирующие размещение
несвязанных молекул в пустотах трёхмерной сетки ("каркаса"), однако
эти модели требуют наличия значит. концентрации несвязанных молекул. В действительности
же их скорее всего содержится незначит. кол-во. Повышенная плотность жидкой
воды по сравнению со льдом I объясняется, как и в случае плотных модификаций льда,
уменьшением объёма в результате искривления связей и отклонения координации
молекул от идеально тетраэдрической. С другой стороны, ср. длина водородных
связей при возрастании температуры увеличивается, что приводит к расширению воды. Наличие
этих двух противоположных тенденций объясняет своеобразную зависимость объёма
воды от температуры.
) соответствует
длине ребра тетраэдра вокруг молекулы воды (рис. 5). Эти данные трудно согласовать
с существующими моделями воды, допускающими наличие в ней ассоциатов, групп, кластеров
(в к-рых молекулы соединены водородными связями), разделённых несвязанными молекулами.
По-видимому, ближе к реальности т. н. клатратные модели (наиб. известная из
них - модель, предложенная О. Я. Самойловым в 1946), постулирующие размещение
несвязанных молекул в пустотах трёхмерной сетки ("каркаса"), однако
эти модели требуют наличия значит. концентрации несвязанных молекул. В действительности
же их скорее всего содержится незначит. кол-во. Повышенная плотность жидкой
воды по сравнению со льдом I объясняется, как и в случае плотных модификаций льда,
уменьшением объёма в результате искривления связей и отклонения координации
молекул от идеально тетраэдрической. С другой стороны, ср. длина водородных
связей при возрастании температуры увеличивается, что приводит к расширению воды. Наличие
этих двух противоположных тенденций объясняет своеобразную зависимость объёма
воды от температуры.
Представление о жидкой воды как о трёхмерной тетраэдрич. сетке из связанных друг с другом молекул впервые
было высказано Дж. Д. Берналом (J. D. Веrnal) и P. Фаулером (R. G. Fowler) в
1933. Как показали эксперим. данные 70-80-х гг., в жидкой воды реализуется нек-рая
случайная тетраэдрич. сетка, отличная от существующих в кристаллич. модификациях
льда или в др. тетраэдрич. координированных кристаллич. структурах. Такая концепция
наилучшим сбразсм согласуется и с результатами изучения воды теоретич. методами
и при помощи численного моделирования на ЭВМ (молекулярной динамики метод и Монте-Карло метод).
Химические свойства
воды. Химически чистая вода состоит почти исключительно из молекул H2O.
Незначительная доля молекул (при 25 0C - примерно одна на 5*109)
диссоциирует по схеме 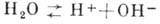 . Протон H+ в водной среде существовать в свободном состоянии не
может и, взаимодействуя с молекулами воды, образует комплексы H6O2+.
Расстояние О. . .О в таких комплексах заметно короче, чем при нормальной водородной
связи между нейтральными молекулами. Но поскольку протон, по-видимому, находится
не точно посредине этой укороч. связи, а ближе к одному из атомов О, то в таком
комплексе можно выделить ион оксония H3O+. Хотя степень
диссоциации в воде ничтожна, она играет большую роль в хим. процессах, происходящих
в разл. системах, в том числе в биологических. В частности, она является причиной
гидролиза солей слабых K-T и оснований и нек-рых др. реакций, протекающих в воде.
. Протон H+ в водной среде существовать в свободном состоянии не
может и, взаимодействуя с молекулами воды, образует комплексы H6O2+.
Расстояние О. . .О в таких комплексах заметно короче, чем при нормальной водородной
связи между нейтральными молекулами. Но поскольку протон, по-видимому, находится
не точно посредине этой укороч. связи, а ближе к одному из атомов О, то в таком
комплексе можно выделить ион оксония H3O+. Хотя степень
диссоциации в воде ничтожна, она играет большую роль в хим. процессах, происходящих
в разл. системах, в том числе в биологических. В частности, она является причиной
гидролиза солей слабых K-T и оснований и нек-рых др. реакций, протекающих в воде.
При повышенных темп-pax происходит разложение воды на элементы: 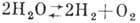 (при давлении 1 атм и температуре 1015 0C разлагается 0,034%, при 2215°-
8,6%, при 2483° - 11% молекул). Под действием УФ-излучения
(с длиной волны 1650 нм) происходит фото-хим. диссоциация воды. Ионизирующие излучения
вызывают радиолиз воды с образованием H2, перекиси водорода H2O2
и свободных радикалов (H, ОН, HO2).
(при давлении 1 атм и температуре 1015 0C разлагается 0,034%, при 2215°-
8,6%, при 2483° - 11% молекул). Под действием УФ-излучения
(с длиной волны 1650 нм) происходит фото-хим. диссоциация воды. Ионизирующие излучения
вызывают радиолиз воды с образованием H2, перекиси водорода H2O2
и свободных радикалов (H, ОН, HO2).
Вода взаимодействует со мн. элементами и веществами. Так, при реакции воды с наиб. активными металлами выделяется
водород и образуется соответствующая гидроокись. При реакции воды со мн.
окислами образуются к-ты или основания. Вода гидролизует гидриды и карбиды
щелочных и щелочноземельных металлов и др. вещества.
Среди кристаллогидратов
особый интерес представляют клатратные гидраты, в к-рых молекулы В,, соединяясь
водородными связями друг с другом, образуют трёхмерный каркас, содержащий крупные
пустоты, в к-рых размещаются молекулы др. веществ (в т. ч. атомы инертных газов,
молекулы углеводородов, CO2, Cl2 и др.). Эти клатратные
гидраты можно рассматривать как неустойчивые в свободном состоянии модификации
льда, стабилизированные внедрившимися в пустоты химически малоактивными молекулами.

Г. Г. Маленков
|
|