Молекулярные кристаллы - кристаллы, образованные молекулами, связанными силами межмолекулярного взаимодействия. Это гл.
обр. ван-дер-ваальсовы силы и водородная связь .Внутри молекул атомы
соединены более прочными ковалентными связями, поэтому плавление, возгонка
и полиморфные переходы в M. к. происходят без нарушения целостности молекул.
К молекулярным кристаллам относятся квазидвумерные соединения (слоистые) и квазиодномерные соединения (цепочечные), где слои и
цепочки связаны силами Ван-дер-Ваальса. M. к. образуют комплексные и элементоорганич.
соединения (рис. 1, а, б), бинарные соединения (H2O, CO2,
HC и др.). В форме M. к. могут существовать нек-рые простые вещества (H2,
O2, N2, галогены).
Строение молекулярных кристаллов определяется принципом макс. заполнения
пространства, симметрией молекул и их укладки. Укладку определяют ван-дер-ваальсовы
силы (энергия связи ~ 1-3 ккал/моль). Макс. заполнение пространства молекулами
произвольной формы достигается выделением отд. слоев. Молекулы в слоях могут
располагаться параллельными и антипараллельными рядами или "ёлочкой"
(рис. 2). При этом обычно достигается координационное число 12 или 14
(реже 8, 10, 16 и др.).
Молекулы располагаются так, что выступы одних
молекул (обычно атомы H) входят в углубления или промежутки соседних. Это способствует
возникновению в молекулярных кристаллах скользящих плоскостей или винтовых осей (плоскости симметрии
встречаются редко, см. Симметрия кристаллов ).Существуют определ. соотношения
между симметрией молекул и M. к.

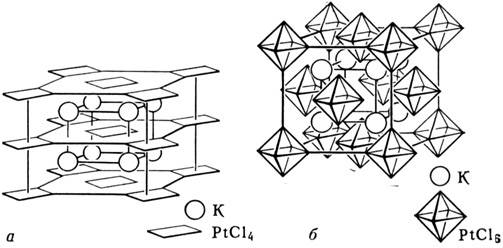
Рис. 1. Структура комплексных соединений,
в которых центральный атом Pt образует
октаэдрические K2PtCl4
(а) и квадратные K2PtCl6 (б) комплексы.
Симметрия молекул и молекулярных кристаллов
Чаще всего молекулярный кристалл имеет моноклинную, ромбоэдрич.
или триклинную структуру; реже более высокосимметричную - тетрагональную, гексагональную
и кубическую.

Рис. 2. Укладка слоев органических молекул.
Mолекулярные кристаллы с водородными связями образуются молекулами
H2O (лёд), спиртов, карбоновых к-т, а также большинством молекул
биол. происхождения (см. Биологический кристалл ).Водородная связь -
направленная, требование плотной упаковки молекул приводит к сближению выступов
(H) одной молекулы с выступами другой (О, N). Отсюда, если молекулы обладают
центром симметрии и двойной осью симметрии, то эти же элементы симметрии появляются
у молекулярных кристаллов. В случае асимметричных молекул в M. к. можно ожидать появления винтовых
осей.
Для молекулярных кристаллов характерны низкие температуры плавления, большие коэф. теплового расширения и сжимаемость, малая твёрдость. Большинство молекулярных кристаллов при комнатной температуре - диэлектрики ,но у нек-рых (органич. красители) наблюдаются полупроводниковые свойства.

Б. К. Вайнштейн
|
|